特別講演
脊髄性筋萎縮症新生児スクリーニングの実施とその課題
宮崎大学医学部看護学科 ちば県民保健予防財団 調査研究センター長
羽田 明



特別講演
宮崎大学医学部看護学科 ちば県民保健予防財団 調査研究センター長
羽田 明
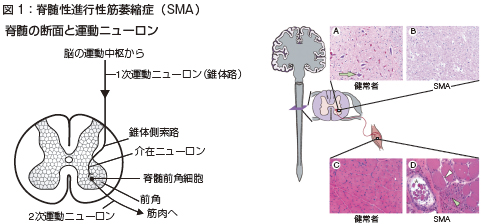
脳の運動神経は脊髄の前角を通って筋肉に行くという経路があります。脊髄性筋萎縮症(SMA)はその経路にある脊髄前角細胞が、遺伝的障害により変性しうまく機能しないために、その先の筋肉細胞が萎縮し、進行性に筋力が低下する下位運動ニューロン病です(図1)。
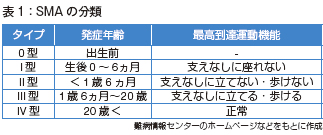 SMAは0型から4型まで分類されています。今回の新生児スクリーニングの場合、特に新生児に発症するⅠ型(重症型)の早期発見が中心となります(表1)。
SMAは0型から4型まで分類されています。今回の新生児スクリーニングの場合、特に新生児に発症するⅠ型(重症型)の早期発見が中心となります(表1)。
Ⅱ型も発見できればいいなという状況です。治療をしなければⅠ型は支えなしに座れない、Ⅱ型は支えなしに立てない・歩けないということになり、Ⅰ型は2歳までに呼吸不全などで死亡します。
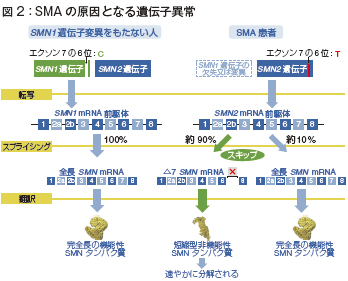 SMAの原因となる遺伝子異常はSMN(survival motor neuron)遺伝子のうちのSMN1遺伝子にみられます。
SMAの原因となる遺伝子異常はSMN(survival motor neuron)遺伝子のうちのSMN1遺伝子にみられます。
図2の左側はSMN1遺伝子変異を持たない正常な遺伝子、右側がSMA患者の遺伝子です。
SMN遺伝子にはSMN1遺伝子と同じ機能を持つSMN2遺伝子があり、同じ方向で同一染色体上にタンデムに位置しています。
SMN1遺伝子とSMN2遺伝子の違いは、エクソン7の6位の塩基です。SMN1遺伝子ではC、SMN2遺伝子ではTとなっています。
正常な場合は、SMN1遺伝子機能が働いて、1番から8番まで附番されたmRNA前駆体ができ、スプライシングを経て全長SMNmRNAができ、完全長の機能性SMNタンパク質が合成されます。
一方、SMAではSMN1の欠失がみられ、正常な完全長の機能性SMNタンパク質が合成できません。Ⅰ型患者の約95%でSMN1遺伝子の欠失がみられています。
そうなると機能が残っているSMN2遺伝子だけが働くわけですが、SMN2遺伝子はエクソン7の6位塩基がTのために、7番をスキップしたSMNのmRNAが約90%合成されます。これは短縮型非機能性SMNタンパク質であり、速やかに分解されてしまいます。残りの約10%が全長SMNmRNAができ、完全長の機能性SMNタンパク質が合成されますから、わずかながら正常な機能が残っているわけです。
こうした病態の理解を基に、近年治療が進歩してきました。
まず、SMA患者のSMN2遺伝子に作用して、正常な完全長SMNタンパク質の発現を増加させる作用機序を持つ核酸医薬品(ASO)がSMA治療薬ヌシネルセンです。
一方、欠失したSMN1遺伝子をアデノ随伴ウイルスのベクターに組み込んだ遺伝子治療により、正常なSMNタンパク質を合成させる作用機序を持つのが新しいSMA治療薬のゾルゲンスマです。
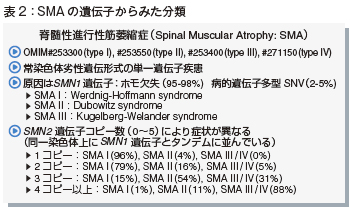 SMAはOMIM( Online Mendelian Inheritance in Man)分類ではtype Ⅰ~Ⅳまで分類されています(表2)。SMAは常染色体劣性遺伝形式の単一遺伝子疾患です。両親がいずれもヘテロ(保因者)で、1/4 の確率で発症することになります。
SMAはOMIM( Online Mendelian Inheritance in Man)分類ではtype Ⅰ~Ⅳまで分類されています(表2)。SMAは常染色体劣性遺伝形式の単一遺伝子疾患です。両親がいずれもヘテロ(保因者)で、1/4 の確率で発症することになります。
原因はSMN1遺伝子で、ホモ欠失が95~98%、病的遺伝子多型が2~5%といわれています。
また、SMN2遺伝子のコピー数(0~5)により症状が異なります。1~2コピーでは病的にシビアなSMAⅠの発症頻度が高く、3~4コピーになるとSMAⅢやⅣの発症頻度が高くなります。
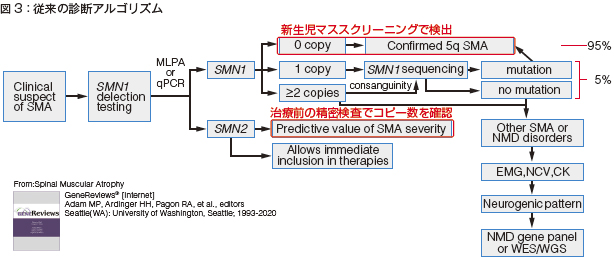
SMAの新生児スクリーニングが始まる前の診断アルゴリズムをみてみます(図3)。
最初にフロッピーインファントであるといったSMAの臨床所見の疑いがある場合、SMN1の欠失を検査します。
SMN1が0コピーであれば確定診断となります。このタイプが95%を占めるわけですから、新生児スクリーニングではこの0コピーのタイプを調べることになります。さらにSMN2のコピー数を確認し、治療に進むというのが現状の診断治療の進め方です。
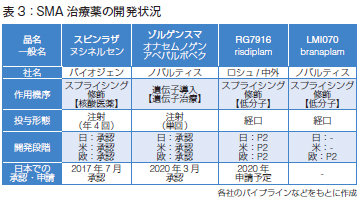 SMA治療薬の開発状況ですが、以前では考えられなかったような新しい治療薬が登場している状況です。すでに承認されているのは2剤です。一つはヌシネルセンで髄腔内注射を年4回行います。
SMA治療薬の開発状況ですが、以前では考えられなかったような新しい治療薬が登場している状況です。すでに承認されているのは2剤です。一つはヌシネルセンで髄腔内注射を年4回行います。
もう一つはゾルゲンスマで、SMN1遺伝子をアデノ随伴ウイルスに組み込んだ遺伝子治療です。2020 年3 月に日本でも承認されました。いずれも日米欧で承認されています。そのあともスプライシングを修飾する治療薬が開発中です(表3)。
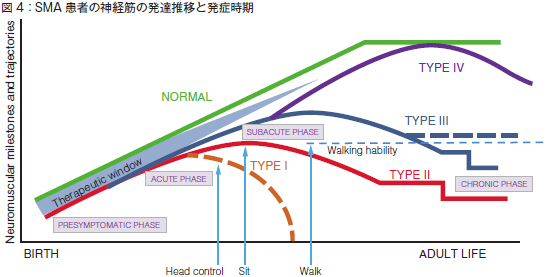
SMAでは症状が発現してしまいますと、治療機会を逃すことになります。SMAの神経筋の発達の状態を健常者とSMAとで比較してみます(図4)。
特にType1では生後まもなく無症候のpresymptomatic phase を経て、acute phase になり、head control ができない状況になります。だいたいその間隔は1ヵ月程度と考えられています。
この時期以降にみつけてもかなりの障害が残ることになります。できるだけpresymptomatic phase で早期発見し、治療を開始することがSMAでは重要なことです。
新生児や小児の遺伝疾患で、どのような疾患を新生児スクリーニングの対象にあげるべきかという議題について、台湾や欧米、特にアメリカなどではthe Advisory Committee on Heritable Disorders in Newborns and Children (ACHDNC)が検討し、推奨疾患リストを発表しています。
その中に、RUSP(Recommended Uniform Screening Panel)というものがあり、スクリーニングに推奨すべき疾患などをまとめています。
2009年には重症複合免疫不全症(SCID)、2013年にはポンぺ病、2015年にはムコ多糖症Ⅰ型、X連鎖性副腎白質ジストロフィー(X-ALD)などが取り上げられました。
そして2018年にSMAが推奨されました。
我が国の新生児マススクリーニングは、自分が臨床医をはじめた40年前に開始されました。遠藤文夫先生の前任者の松田一郎先生が全国で始めたという経緯と歴史があります。その後、1990年以降タンデムマスが開始され、現在はRUSPによるリストアップの段階となっています。
台湾でSMAの新生児スクリーニングの成果が出始め、アメリカでも州単位でSMAのスクリーニングが開始されています。2020年7月1日時点で、35州、65%で開始されています。
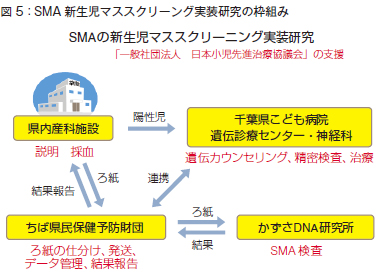 2019年11月に遠藤文夫先生から、千葉でSMAの新生児マススクリーニングができないかと打診がありました。日本でもSMAのスクリーニングをはじめようということになり、SMAの新生児マススクリーニング実装研究の枠組みを考えました。その流れは図5 のようになります。
2019年11月に遠藤文夫先生から、千葉でSMAの新生児マススクリーニングができないかと打診がありました。日本でもSMAのスクリーニングをはじめようということになり、SMAの新生児マススクリーニング実装研究の枠組みを考えました。その流れは図5 のようになります。
私の所属がちば県民保健予防財団で、現状のマススクリーニングはこの方法で実施されています。
すなわち、県内のろ紙が産科施設からすべて運びこまれてきます。
ここでろ紙の仕分け、発送、データ管理、そしてタンデムマスの検査結果を解析し、産科に結果報告を行います。陽性児がでましたら、千葉県こども病院、千葉大に連絡して治療するように依頼します。
SMAもこの枠組みにいくつか工夫を加えれば新生児マススクリーニングが可能と考えましたが、想像以上に大変でした。最終的には、かずさDNA研究所にSMA検査を依頼してなんとか実施できるようになっています。
本研究の主要構成メンバーは以下の通りです。
● ちば県民保健予防財団:代謝異常検査室(安片恭子部長、稲田佳美)、調査研究センター(羽田明、小海誠、藤田美鈴、石井健司、房枝みち子)
● 千葉県こども病院:村山圭先生、高柳正樹先生(平成帝京大学)
● かずさDNA 研究所遺伝子検査室:小原収先生、細川淳一先生、糸賀栄先生
千葉県における実装研究への戦略については、次の1~7までの項目をクリアしていく必要があると考えており、それを実践してきました。現在は5まで達成しております。それぞれの経緯について説明いたします。
1. 産科婦人科医会の協力同意を得る
① 千葉大学生殖医学講座教授、生水真紀夫先生にご相談し、②、③ の実施の指示を受けました(2019年12月13日)。
② 千葉県産科婦人科医学会、理事会で趣旨説明と質疑応答(羽田明)(2020年1月24日)
③ 千葉県産科婦人科医学会、学術講演会で説明(高柳正樹先生)(2020年2月8日)
これらの活動によって、産科婦人科医会の協力の同意を得ることができました。
2. 既存の新生児マススクリーニングに使われている血液ろ紙の本研究への使用許諾を、千葉県および千葉市から得る
① 千葉県健康福祉部児童家庭課母子保健班、千葉市保健福祉局健康部健康支援課母子保健班の担当者に説明(千葉県庁にて、高柳正樹先生、村山圭先生、羽田明)(2019年12 月25 日)
② その後、千葉県、千葉市の庁内での検討を経て既存のろ紙の使用を許諾(約1ヵ月後)
千葉県および千葉市の担当者も速やかに対応していただき、既存のろ紙の使用の許諾をえることができました。
3. 研究参加施設の倫理審査の承認
① ちば県民保健予防財団の倫理審査委員会で承認(2020年2月4日)
② かずさDNA 研究所倫理審査委員会承認(2020年4月2日)
③ 千葉県こども病院倫理審査委員会承認(2020年3月9日)
④ 平成帝京大学倫理審査委員会承認(2020年6月24日)
本実装研究では、インフォームド・コンセントを含めた研究参加施設の倫理審査の承認が必要でした。関連施設において、倫理申請書を検討いただき、すべての参加施設で順次承認を得ることができました。
4. 解析機関および解析手法の決定
① 解析受諾先候補:積水メディカル・かずさDNA 研究所の2か所(2020年2月4日)
② 積水メディカルとの打ち合わせの結果、解析キット・解析フローが未完成のため断念。かずさDNA研究所に絞る(2019年12月17日)
③ 確率されている検査キットはNeo Mdx キット(Perkin Elmer)のみ→決定
(1)TREC、KREC、SMN1、RPP30 が同時検出可能なマルチプレックスアッセイ(qPCR)
(2)必要な機器
1) ろ紙血からろ紙血をマイクロプレートの希望部位に打ち抜くパンチャー:Wallac DBS Puncherを財団に納入(2020年3月)
2) ろ紙血からDNAを抽出するロボットが未納入(2020年7月にかずさDNA研究所に納入予定、かずさでマニュアル対応)
3) マルチプレックスに割り当てられた定量PCR機器二台が未納入(2020年7 月にかずさに納入予定、かずさに現有する1台のみでぎりぎりの対応)
解析機関および解析手法の決定には困難が伴いました。解析受諾先候補は2つありました。日本で作成した解析キットでやりたいという考えもあり、積水メディカルと検討しましたが、解析フローが未完成で断念。難病の遺伝子検査ですで連携しているかずさDNA研究所とも検討し、すでに確立されている検査キット、MDxキット(Perkin Elmer)のみで実施することに決定しました。この検査キットはTREC、KREC、SMN1、RPP30が同時検出可能です。
他にも必要となる機器がいくつかありました。
ろ紙血からろ紙血をマイクロプレートの希望部位に打ち抜くパンチャーが必要でした。年間4万件以上に及ぶろ紙血からDNAを抽出するロボットも必要でしたが、2020年7月に納入予定です。
マルチプレックスに割り当てられた最新型の定量PCRの機器2台も未納入で、かずさDNA研究所に現存する1台で対応しています。
これらがすべて揃えば、かなりスムーズに検査が進むと期待しています。
5. 検体調整および解析機関への送付と結果報告の手順に関するプロトコールを作成
① バーコード管理による解析ろ紙血の抽出(かずさDNA 研究所細川淳一先生によるプログラム作成)
② 産科施設への資材(説明文書、同意文書、バーコードシール(ろ紙と研究承諾書に貼り付ける))の送付
③ 産科施設からろ紙血とともに同意文書が財団に返送
④ 財団ですべてのろ紙血の情報入力
⑤ 入力された個人データをダウンロードし、別のパソコンに移植
⑥ パソコン上で他の検査用のパンチアウトしたろ紙とバーコードにより、本研究参加者を抽出
⑦ 参加者のみをパンチアウトし、マイクロプレートを梱包、かずさに送付
⑧ かずさでバーコードを管理した検体を解析、結果を財団にメールで報告
ろ紙受取日を含めて5日で結果返却を達成しています。
検体調整および解析機関への送付と結果報告の手順に関するプロトコールを作成するにあたって、解析ろ紙血を抽出するところから、徹底的にバーコード管理することを考えました。そのプログラム作成はかずさDNA研究所の細川淳一先生にお願いしました。
産科施設では、財団から送付したバーコードシールのバーコードを同意文書とろ紙血に貼って、財団に返送してもらいます。
財団ですべてのろ紙血の情報を入力しますが、その中には本研究に同意を得た方と同意を得ていない方のすべてが含まれます。このすべての入力データをダウンロードして、同意を得た本研究参加者を抽出します。そして参加者のみをパンチアウトし、マイクロプレートをかずさDNA研究所に送付するという流れを確立することができました。
かずさDNA研究所からは結果をろ紙受取日を含めて5日で返却を達成しています。
現在は5まで達成しております。5月から開始したSMAスクリーニングの実施実績状況ですが、月を追うごとに実施施設数、実施率が上昇し、6~7月は83%を超えています。7月15日現在でろ紙総数7,751名、SMA実施数5,611名で、陽性者は今のところゼロです。
6. 2021 年度から有料検査として実装
7. 公費検査として許可されることをめざす
2021年度から有料検査として実装することになります。有料化する場合、適正な費用の設定、徴収方法など、各方面と協議をして検討しているところです。最終的には公費検査として許可されることをめざすわけですが、SCIDも同時に検査可能であり、SCIDを含めて公費検査として許可されることが目標となります。SCIDにおいても千葉県からろ紙の使用許可の承認を得られる意向を得ていますので、SCIDも合わせて何とか実装していきたいと考えています。以上です。
中村:検査の同意を取ってくださる産科の先生方は、共同研究者としての位置付けでしょうか?
羽田:産科施設はデータを提供していただくだけですから、共同研究者とする必要はないと現在の倫理指針上でもなっております。
中村:実施率83%とありましたが、この分母は全体の新生児数の値か、あるいは協力して参加してくださっている産科施設の新生児数の値か、とちらでしょうか?
羽田:千葉県での全体の新生児数に対する83%です。
中村:今は無料で実施率も高くなっているという側面もあるかと思います。もし、有料になったとき、対策や方法を何か具体的に考えていますか?
羽田:むずかしい問題です。産科からの申請に基づいて、希望者から検査費用を徴収するという方法ですと、SMA検査結果が遅れてしまうという現実的な問題があります。もし本人の同意があれば、例えばスマホのアプリなどを使って振り込んでもらい、すぐ解析するという方法もあるかもしれません。
中村:宮崎大学の澤田浩武先生、そのあたりはどうされていますか。
澤田(浩):宮崎県では産科施設からろ紙を送ってもらう時に、赤ちゃんのリストももらいますが、そこに有料のSMA検査に進む人(同意した人)には〇をつけてもらっています。その時点で支払いの有無に関係なく、同意した人のろ紙が到着したと同時に検査に進むことができます。その後結果を産科施設に戻した後、産科で費用を徴収するということになります。
羽田:その方法はいいですね。検討してみます。
中村:公費検査にしていくということですが、そのためには訴求すべき事実などを認知してもらうことが重要です。SCIDのスクリーニング検査ではロタウイルに対する生ワクチン投与の危険性を小児科の先生方に訴えることが決め手になるでしょう。SMAのスクリーニングでもそういった切り口のようなものがあるのでしょうか?
羽田:公費検査となると政策変更になるわけですから、例えばSMAの患者会の力をお借りして、意見などを収集し、厚生労働省に反映していくといったことも検討しています。
千葉県や千葉市への取り組みも考えています。
中村:琉球大学の知念先生、ご質問をお願いいたします。
知念:SMAの料金設定を今後、どのように決めていくのか、その考え方を教えてください。
羽田:検査費用を安くしすぎると全国に普及しないということになるでしょう。それからSCIDのこともあるように、今後新しい検査が増えていくことも予想されます。これらを総合的に考えて、今後の日本のマススクリーニングにとって最善なのかを考えていく必要があると思います。
新生児スクリーニングにかかわる多くの産科や小児科の医師の皆様からご意見をうかがって、ある程度の余裕のある上限を検討して、新しい検査の追加などを考慮した料金設定にしていくことが必要と考えています。そしてその中から、公費へ移行する検査を検討していければよいかと考えています。
中村:宮崎でも費用負担に関してはやはり産科の先生方がいちばん苦労されていると思いますが、この費用についてご意見はありますか?
澤田(浩):宮崎ではSCIDとLSD合せて約6,000円です。SMAを入れてもせいぜい1,000~2,000円が限界という印象です。ですから、現状では受検率を上げていくことが重要です。またSCIDに対しては将来的に公費検査として受け入れやすい背景があると思います。そうなった場合、その分で空いた費用で新しい検査を組み入れていければいいと考えております。

教育講演1・教育講演2 座長
熊本大学大学院生命科学研究部小児科学講座 准教授
松本 志郎

教育講演1
熊本大学大学院生命科学研究部小児科学講座 教授
中村 公俊

教育講演2
熊本大学大学院生命科学研究部小児科学講座
澤田 貴彰

教育講演3・教育講演4 座長
熊本大学病院総合周産期母子医療センター 講師
坂本 理恵子

教育講演3
国立病院機構熊本医療センター小児科 部長
水上 智之

教育講演4
宮崎大学医学部看護学科 基礎看護学領域 教授
宮崎大学医学部附属病院小児科
宮崎県新生児マススクリーニング検査専門委員会 委員長
澤田 浩武

特別講演 座長
熊本大学大学院生命科学研究部小児科学講座 教授
中村 公俊

特別講演
公益財団法人 ちば県民保健予防財団 調査研究センター長
羽田 明

熊本大学大学院生命科学研究部小児科学講座 教授
中村 公俊